Cohorte RaDiCo-ECYSCO / RaDiCo-ECYSCO Cohort
Cohorte européenne sur la cystinose
European Cystinosis Cohort
Investigateur Coordinateur : Dr Aude Servais
Contact : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
| Click here to download the RaDiCo-ECYSCO info-sheet in English | 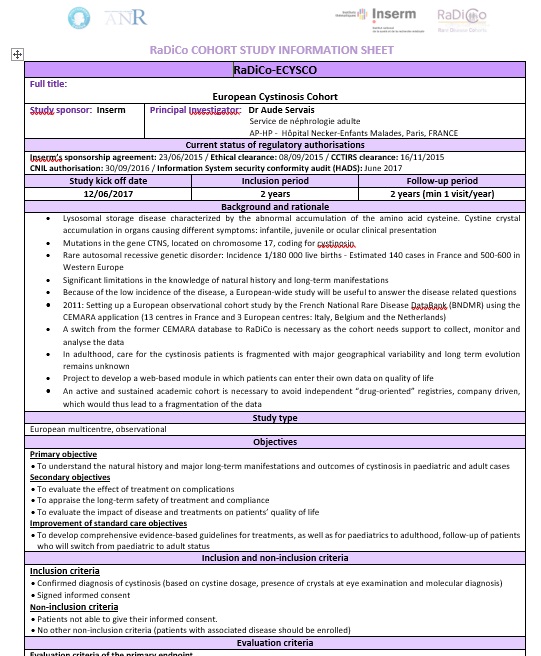 |
PARTICIPANTS
Promoteur : Institut National de la Santé et de la Recherche Médicale (Inserm)
Institutions assurant la coordination scientifique : Inserm / Assistance Publique - Hôpitaux de Paris (AP-HP), Hôpital Necker Enfants Malades - Centre de référence des microangiopathies thrombotiques (CNR-MAT)
Investigateur Coordinateur de l'étude : Dr Aude SERVAIS, AP-HP Service de Nephrologie Adulte et Centre CNR-MAT, Hôpital Necker Enfants Malades, Paris, FRANCE
Investigateur Co-Coordinateur : Pr Patrick NIAUDET, Néphrologiste pédiatrique, AP-HP Hôpital Necker Enfants Malades, Paris, FRANCE
Sites d'inclusion partenaires : Centres experts de la cystinose
En France: Services de Néphrologie Adulte et Pédiatrique (de la Filière ORKiD)
En Europe: Louvain (BE), Nijmegen (NL), Traunstein, Hannover (DE), Rome (IT), Barcelone (SP)
Inserm UMR S933 : L'équipe RaDiCo, Paris France
Filière française de santé des maladies rénales rares de l’enfant à l’adulte : ORKiD (Orphan Rare Kidney Diseases)
Etat de la question et objectifs de l'étude
La cystinose est une maladie héréditaire rare. Son incidence est d'environ 1/180000 naissances et on estime sa prévalence à environ 140 cas en France et 5-600 cas en Europe de l'Ouest.
Dans la majorité des cas, la maladie se manifeste chez le nourrisson par une atteinte rénale sévère progressant vers l'insuffisance rénale nécessitant un traitement de suppléance. Le traitement par cystéamine et la transplantation rénale permettent maintenant une survie de ces patients jusque dans la 5ème décade. Un traitement précoce et prolongé permet une amélioration de l'espérance de vie et retarde l'apparition de l'insuffisance rénale et des complications extra-rénales.
En 2011, une étude européenne observationnelle de cohorte a été initiée en France et dans trois centres européens utilisant la base de données CEMARA (Développé par la Banque Nationale de Données Maladies Rares (BNDMR), CNIL autorisation N°1187326).
La poursuite de cette cohorte et son développement à d'autres centres européens est essentielle afin de comprendre l'histoire naturelle et les principales complications à long terme de la cystinose.
La cohorte RaDiCo-ECYSCO promue par l'Inserm a pour objectif principal de comprendre cette histoire naturelle et ces principales manifestations et effets à long terme pour les patients pédiatriques et adultes. L'étude a également pour objectif :
• Evaluer l'impact de la maladie et des traitements sur la qualité de vie des patients,
• Evaluer l'effet du traitement sur les complications de la maladie,
• Evaluer la tolérance du traitement à long terme et son observance
Cette étude permettra également de développer des recommandations pour la prise en charge des patients et de proposer un système d'audit vis-à-vis de ces recommandations pour maintenir les meilleurs standards de soins.
Population concernée
Les patients concernés sont des enfants (à partir de 6 mois environ) et des adultes atteints de cystinose.
L'objectif est d'inclure au minimum 400 patients (prévalents et incidents confondus) adultes et pédiatriques qui seront suivis pendant 2 ans par des centres en France, Belgique, Italie, Espagne, Pays-Bas ou Allemagne.
Les patients prévalent ont pu être déjà inclus dans la base CEMARA de la Banque Nationale de Données Maladies Rares gérée par l'AP-HP (autorisation CNIL n° 1187326). Les patients non-inclus dans la base CEMARA sont inclus directement dans la base RaDiCo-ECYSCO.
Les patients inclus dans la base CEMARA consentant à participer à l'étude RaDiCo-ECYSCO pour lesquels les données rétrospectives doivent être importées dans la base RaDiCo-ECYSCO, sont des patients suivis par des centres en France, Belgique ou Italie.
Les patients qui seront inclus directement dans la base RaDiCo-ECYSCO, sont des patients suivis par des centres en France, Belgique, Italie, Espagne, Pays-Bas ou en Allemagne.
Méthode d'observation ou d'investigation retenue
Il s'agit d'une étude observationnelle longitudinale multicentrique européenne rétrospective et prospective, permettant la collecte de données cliniques cohérentes et comparables pour les patients atteints de cystinose.
Origine et nature des données nominatives recueillies. Justification du recours à celles-ci
Aucune donnée nominative n'est recueillie dans cette étude. Les informations relatives aux patients sont saisies sous une forme indirectement nominative comparable à celle utilisée dans le cadre des essais thérapeutiques et conformes aux exigences de la loi « Informatique et Libertés ».
Seules les personnes autorisées connaissent la correspondance entre le numéro attribué au patient et l'identité du patient.
Les données rétrospectives des patients prévalents déjà rentrées (en France, Belgique ou Italie) dans la base CEMARA de la banque Nationale de Données Maladies Rares (BNDMR ; autorisation CNIL n° 1187326) sont importées après avoir été rendues confidentielles dans la base de données RaDiCo-ECYSCO. Les données prospectives sont quant à elles directement saisies dans la base RaDiCo-ECYCO sous forme confidentielle. La base de l'étude RaDiCo-ECYSCO se substitue au recueil préalablement effectué dans CEMARA.
Les démarches réglementaires pour la base CEMARA sont faites dans chaque pays sous la responsabilité des centres participants. Une fois que toutes les démarches réglementaires spécifiques à chaque pays pour l'étude RaDiCo-ECYSCO auront été faites, les données seront importées de la base CEMARA ou nouvellement collectées selon les modalités décrites dans le paragraphe suivant.
Mode de circulation des données
Un même e-CRF (électronique – Case Report Form, REDCap), accessible par connexion internet, est utilisé pour cette étude par tous les centres dans tous les pays participants. Il permet la collecte de données cliniques et de qualité de vie ainsi que leur validation et leur exploitation en temps réel (module complet de monitoring et de data management). L'e-CRF est en conformité avec les normes et recommandations suivantes: FDA 21 CFR Part 11, Bonnes Pratiques Cliniques, Bonnes Pratiques Epidémiologiques et l'ICH Q6. Les données saisies par le médecin ou le patient dans la base de données adossée à l'e-CRF sont sécurisées (l'accès aux serveurs est sécurisé par un identifiant et un mot de passe, et les informations sont cryptées et uniques à chaque instant ; divers niveaux d'accès sont proposés selon le rôle dans l'étude). L'e-CRF est conforme aux exigences de la loi « Informatique et Libertés ». Les données sont conservées sur un serveur informatique sécurisé et agrée HADS (Hébergement Agréé Données de Santé). A la fin de l'étude, la base de données sera extraite et importée dans un logiciel d'analyses statistiques (R ou équivalent). Toutes publications ou communications des résultats ne feront état que de données statistiques agrégées strictement anonymes.
Les patients remplissent les auto-questionnaires de chez eux ou lors de leurs consultations de suivi habituel en se connectant à une session Web sécurisée une interface sécurisée et confidentiellepour accéder aux formulaires. Les données seront directement intégrées dans la base de données RaDiCo-ECYSCO. En cas de non accès à internet, le remplissage des auto-questionnaires se fera via un formulaire papier.
Toutes les données recueillies dans la base seront rendues confidentielles et seulement identifiées par un code se composant de l’acronyme de la cohorte suivi d’un numéro spécifique au centre l’ayant inclus et d’un numéro correspondant à son ordre d’inclusion. Seuls les médecins en charge du suivi des patients conservent sur site une table de correspondance avec l’identité des patients qu’ils ont inclus.
Les données sont également associées à l’Identifiant Maladies Rares développé par la BNDMR qui se compose de 20 caractères générés par un algorithme à partir des nom, prénom, date de naissance et sexe, afin de s’inscrire dans le cahier des charges du Plan National Maladies Rares de la Direction Générale de l’Offre de Soins (DGOS).
Durée et modalités d'organisation de la recherche
La durée prévue de cette étude ouverte aux inclusions depuis juin 2017, analyse des données incluse, est d'environ 5 ans (2 ans d'inclusion et 2 ans de suivi, auxquels s'ajoutent les étapes pour le data-management et les analyses statistiques).
Chaque partenaire étranger préparera des formulaires d'information et de consentement, conformes à leur réglementation locale, à partir de la version anglaise fournie par la gouvernance de la cohorte. Les démarches réglementaires ont été faites sous la responsabilité de l'Inserm en France et sous la responsabilité des centres participants en Belgique, Italie, Espagne, Pays-Bas et Allemagne.
Les centres participants informent chaque patient et obtiennent leur consentement avant de les inclure dans l'étude et de commencer la collecte de leurs données. Ils informent également les patients ayant été inclus dans la base CEMARA que leurs données préalablement stockées dans cette base migreront vers la base RaDiCo-ECYSCO qui remplacera CEMARA. Le transfert ne se fera qu'après consentement des patients.
La date d'importation des données rétrospectives présentes dans la base CEMARA et la date de début des inclusions de patients dans l'étude RaDiCo-ECYSCO pourront être différentes d'un pays à un autre en fonction des délais et démarches réglementaires spécifiques à chaque pays participant.
Les données médicales prospectives seront recueillies au moins une fois par an et plus si possible en fonction du suivi habituel du patient par le centre l'ayant inclus dans l'e-CRF de l'étude.
Le patient remplira au minimum une fois par an un auto-questionnaire, et si possible quatre fois par an (une fois par trimestre/saison), lors de ses consultations de suivi habituel ou en se connectant à une interface sécurisée.
Méthode d'analyse des données
Compte tenu du faible nombre de patients (stratification des patients selon leur statut), des analyses statistiques seront effectuées en fonction de la taille de l'échantillon final obtenu et de sa conformité à la distribution normale; par la suite, des analyses statistiques paramétriques ou non paramétriques seront effectuées. Tous les efforts seront faits pour atteindre de grands groupes de patients suffisants pour les différentes analyses. Vu le nombre de patients déjà suivis par les centres, nous considérons cependant que cet objectif est réalisable.
L'analyse portera sur tous les patients inclus dans l'étude (au minimum 400 patients adultes et pédiatriques en France, Belgique, Italie, Espagne, Pays-Bas et Allemagne. Tous les paramètres collectés seront décrits et analysés. Les statistiques descriptives concerneront:
• Les variables quantitatives: taille de l'échantillon, moyenne, écart type (SD), minimum et maximum, médiane (quartiles sera accordée si nécessaire);
• Les variables qualitatives: la distribution et les fréquences.
Justification du nombre de sujets ou analyse de la puissance
Compte-tenu du contexte (maladie rare), et du peu de données disponibles permettant d'établir des hypothèses statistiques, le calcul de puissance et le nombre de patients « nécessaire » pour cette étude ne peut être calculé. L'ensemble des patients suivis en France, Belgique, Italie, Espagne, Pays-Bas ou Allemagne disponibles et acceptant de participer à l'étude sera inclus.




